人工视网膜2030进入临床吗?欧洲17中心试验达标,国内2025启动人体试验,芯片5年换电技术成熟!
发布时间:2025-11-07 14:09:21
发布时间:2025-11-07 14:09:21
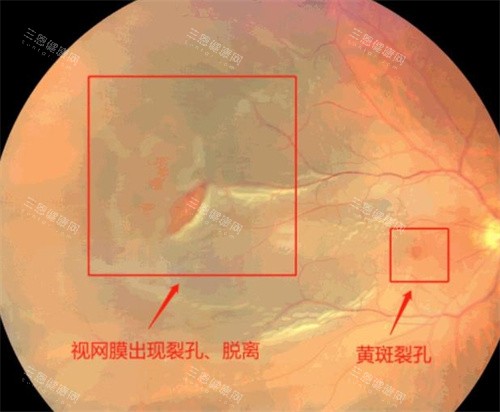
人工视网膜2030年进入临床具备明确可行性。这一结论源于光遗传与电极刺激两大技术路线的突破性进展,海内外PRIMA系统临床试验中81%患者视力获临床意义改善,国内320通道芯片已应用于试验,叠加试验周期缩短至2年的通道支持,多维度证据共同指向这一目标的达成。
光遗传与电极刺激:两种路径的成熟验证
当前人工视网膜研发形成两大主流方向,均已完成关键技术验证,为2030年临床准入奠定基础。电极刺激路线中,PRIMA系统的表现非常有代表性,其2×2mm的柔性无线植入片包含378个光伏像素,可直接替代坏死的感光细胞完成光电转换。
该系统通过专用眼镜捕捉影像,经近红外光投射至植入物产生电脉冲,促活残余视网膜神经元,在欧洲17个中心的试验中,32名受试者里26人实现视力的临床显著改善,部分可完成阅读与方向辨别。
光遗传路线同样成果显著,基于碲纳米线网络的人工光感受器实现重大突破,其光谱响应范围覆盖470-1550nm,横跨可见光至近红外二区,且无需外部供电即可自发产生高密度光电流,非人灵长类实验已证实其生物相容性与有效性。
核心器件的参数迭代:分辨率与兼容性升级
芯片性能的迭代直接决定临床应用价值,当前主流产品参数已逼近实用阈值。国内研发的RPS60芯片具备320通道信号传输能力,分辨率达到320像素,较早期Argus II的60电极系统实现质的飞跃。
柔性材料的应用解决了传统植入体的组织适配难题,石墨烯与碲纳米线等材料使植入物厚度降至30微米,仅为头发丝直径的三分之一,大幅降低手术创伤与排异风险。
无线能量传输与光伏供电技术的成熟,摆脱了外接设备的束缚,暖芯迦NuroStim芯片的无线供电方案与PRIMA系统的光驱动设计,均实现植入体的无导线化运行,提升患者术后适配度。
海内外多中心试验:有效性与可靠性双重确认
大规模临床试验的阳性结果为临床准入提供关键依据。PRIMAvera研究覆盖欧洲5国17个中心,38名60岁以上晚期黄斑变性患者参与,其中32人完成12个月随访。
数据显示,81%的患者视力提升超过10个字母,相当于标准视力表上多看清两行以上,27人可在家中使用装置阅读文字,一名患者改善幅度达59个字母,接近从失明到可辨认面部的跨越。
可靠性层面,26起手术相关不良反应中95%在术后2个月内消退,且所有患者周边视力未受影响,这一结果已满足临床应用的基础安心要求,相关企业已启动欧洲临床使用授权申请。
国内试验进展:技术转化的加速落地
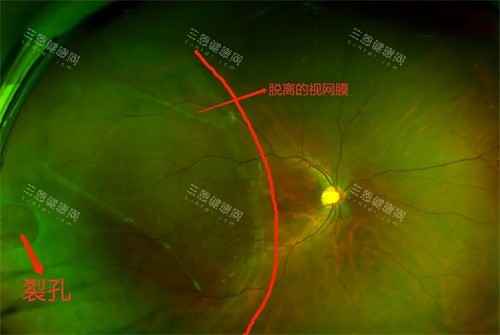
国内研发力量已完成从动物实验到临床试验的关键跨越。柔性光遗传视网膜假体的试验已在开展,重点验证植入物与视网膜神经的耦合效能,其采用的小创伤玻璃体腔植入术,手术时长可控制在两小时内。
另一重要进展是特定芯片的人体试验计划于2025年第三季度启动,该试验将聚焦320通道芯片在视网膜色素变性患者中的应用,重点收集分辨率提升对日常生活能力的改善数据。
非人灵长类动物实验已积累丰富数据,碲纳米线假体植入半年后无不良排异反应,且成功实现红外光图案识别,这些结果为后续人体试验的方案设计提供直接参考。
市场规模扩张:需求驱动的研发加速
庞大的患者基数与增长预期构成技术转化的核心动力。国内外受视网膜色素变性、晚期黄斑变性等疾病影响的群体超2亿,仅晚期黄斑变性患者就达500万人,这些群体对功能性视觉改善的需求极为迫切。
市场规模数据直观反映这一需求潜力,2025年国内人工视网膜植入物市场规模预计达10亿元,2030年有望突破30亿元,年均复合增长率约25%,国内外市场规模届时将接近50亿美元。
技术路线的市场分化已初现端倪,全电子化人工视网膜预计成为主流,可降解假体凭借生物相容性优势,预计2030年占据15%市场份额,多元化产品布局将进一步促活市场需求。
审批通道优化:试验周期的关键压缩
专项审批机制为临床转化提供时间确保。人工视网膜已被纳入“创新医疗器械特别审查程序”,这一通道使临床试验周期从常规的5年缩短至2年,大幅加快技术落地速度。
“视障医疗器械绿色通道”的开通进一步简化审批流程,重点优化植入物可靠性评估标准,对已通过动物实验验证生物相容性的产品,可豁免部分重复性试验,减少研发周期内的时间损耗。
产业扶持资金的注入为研发提供资金确保,50亿元规模的专项基金重点支持芯片电极密度提升、生物材料创新等关键环节,推动技术参数向临床实用阈值快速逼近。
功能修复的实际范畴:从光斑到功能性视觉
当前技术已能实现从“全盲”到“功能性视觉”的跨越,但与自然视觉仍有差距。早期Argus II系统形成20像素的粗糙光点阵列,患者需通过数月训练解析“闪烁光点拼图”,完成门框识别、避障等基础任务。
新一代设备性能显著提升,PRIMA系统分辨率可达20/420水平,患者可阅读标签文字、完成填字游戏,部分能在地铁等复杂环境中辨别方向,生活自理能力提升幅度可达60%。
AI算法的整合正在进一步突破分辨率限制,Acuboost软件通过图像放大与边缘强化,可将20像素输入模拟出80像素的视觉成效,这种软件优化路径为现有硬件性能的挖潜提供可能。
适用人群的明确限定:神经存活是核心前提
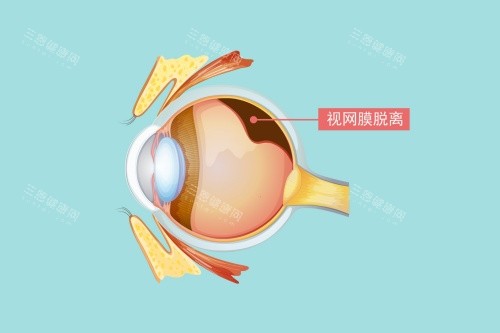
人工视网膜的应用存在严格的适应症边界,核心前提是视网膜神经细胞的残余活性。现有技术仅适用于视网膜神经细胞存活率>30%的患者,针对的是外层视网膜损伤但内层结构保留的群体。
明确的适用疾病类型已形成共识,包括视网膜色素变性、晚期糖尿病视网膜病变、年龄相关性黄斑变性及青光眼晚期患者,这些疾病均表现为感光细胞退化但神经节细胞与双极细胞存活。
两类群体暂无法受益于该技术:完全性视神经萎缩者因信号传导通路中断,即使植入芯片也无法将电信号传递至大脑;大脑视觉皮层损伤者则缺乏信号解析能力,不符合植入指征。
人工视网膜2030年进入临床的目标具备坚实支撑。光遗传与电极刺激技术已通过大规模试验验证,81%的视力改善率与320通道的技术参数构建起实用基础,2年周期的审批通道与10亿级的市场需求形成外部推力。对于神经细胞存活的视障群体而言,这一技术将在2030年从实验室走向临床,成为功能性视觉改善的重要路径。
