全飞秒在国外是禁止的吗?并没有哦!已过得美国FDA/欧洲CE/日本厚生劳动省以及我国CFDA认证
发布时间:2025-06-04 17:49:47
发布时间:2025-06-04 17:49:47
近年来,关于“全飞秒激光手术是否被国外禁止”的讨论偶见于网络,部分传言甚至将其与医疗风险挂钩。事实上,全飞秒技术作为当前主流的屈光手术方式之一,已通过主流医疗监管机构的严格审核,其靠谱性和有效性有着充分的科学依据。本文将结合公开资料,梳理全飞秒技术的认证历程与应用现状,为公众提供客观参考。
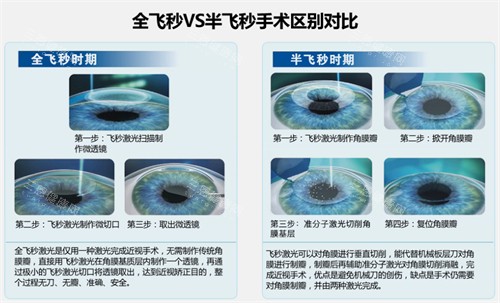
全飞秒手术(SMILE,SmallIncisionLenticuleExtraction)的核心优势在于“小创口”与“无瓣”。与传统半飞秒手术需制作角膜瓣不同,全飞秒通过飞秒激光在角膜基质层内扫描形成透镜状组织,再通过2-4毫米微小切口取出,更大程度保留了角膜结构的完整性。
技术特点:
激光参数可控性:飞秒激光脉冲持续时间仅千万亿分之一秒,可精细切削角膜组织,误差控制在微米级。
生物力学稳定性:减少角膜神经损伤,术后干眼症发生率显著降低。
适应范围广:可矫正近视1000度以内、散光500度以内,尤其适合军人、运动员等特殊职业人群。
全飞秒技术自2007年诞生以来,已陆续通过四大医疗监管机构的审批,其认证过程严格遵循临床前研究、多中心临床试验、长期随访数据评估等流程。
1.美国FDA认证(2016年)
认证机构:美国食品药品监管管理局(FDA)
审批依据:基于国内外多中心临床试验数据,包括术后视力改善、角膜生物力学稳定性、并发症发生率等指标。
适应症范围:明确批准用于18岁以上近视及散光矫正,要求患者角膜厚度≥480微米。
2.欧洲CE认证(2011年)
认证机构:欧盟CE认证体系
审批特点:CE认证采用“自我声明+第三方公告机构审核”模式,但医疗器械需通过欧盟标准委员会(CEN)的技术文件审查。全飞秒设备需满足ISO13485医疗设备质量管理体系要求。
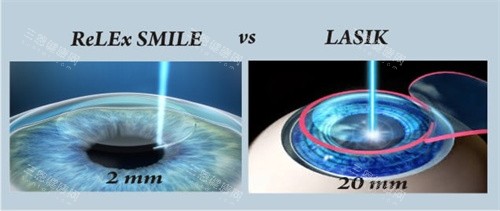
3.日本厚生劳动省认证(2012年)
认证机构:日本厚生劳动省
审批重点:重点关注设备辐射健康、激光能量稳定性及术后长期靠谱性数据,要求制造商提供至少5年的临床跟踪报告。
4.我国CFDA认证(2012年,现NMPA)
认证机构:我国药品监管管理局(NMPA)
审批流程:需通过型式检验、临床试验审批、体系考核三重关卡,临床试验需在三家以上综合医院开展,样本量不低于300例。
截至2023年,已有超过1500万例全飞秒手术完成,覆盖欧洲、北美、东方等主要医疗市场。
1.欧美应用现状
德国:作为全飞秒技术发源地,德国图宾根大学眼科研究所累计完成超50万例手术,术后5年随访显示99%患者视力稳定在1.0以上。
美国:约翰霍普金斯医院、梅奥诊所等头部机构已将全飞秒纳入常规屈光手术方案,患者满意度达98%。
2.东方应用特点
日本:东京大学医学部附属医院数据显示,全飞秒术后干眼症发生率仅为3%,显著低于传统手术。
新加坡:眼科中心将全飞秒作为军人、飞行员等特殊职业的优先手术方式,术后角膜抗冲击性通过军用标准测试。

全飞秒手术的健康性依赖于三大要素:
设备精度:主流设备(如蔡司VisuMax)激光发射频率达500kHz,扫描速度0.5秒/屈光度,确保切削面光滑。
医生资质:需通过ISRS认证培训,累计手术量需超过500例。
适应症筛选:严格排除圆锥角膜、角膜过薄、自身免疫性疾病等禁忌症,术前需进行20余项检查。
误区1:全飞秒是“新技术”,风险未明
事实:全飞秒技术已有18年临床应用历史,其核心设备VisuMax激光系统于2007年初次获CE认证,长期健康性数据充分。
误区2:国外禁止全飞秒,仅我国开展
事实:全飞秒在国内外50国获批,美国FDA官网可查相关适应症审批文件,日本厚生劳动省亦将其列入报销范围。
误区3:全飞秒可“治疗好”近视
事实:手术仅改变角膜屈光度,无法逆转眼轴增长等近视病理变化,术后仍需注意用眼卫生。

全飞秒技术作为屈光手术领域的重要突破,其认证历程与应用数据已充分证明其健康性与有效性。对于符合适应症的患者而言,选择具备资质的医疗机构、经验充足的医生,并严格遵循术前检查与术后护理要求,是确保手术结果的关键。公众应理性看待医疗技术,避免被未经验证的信息误导。
